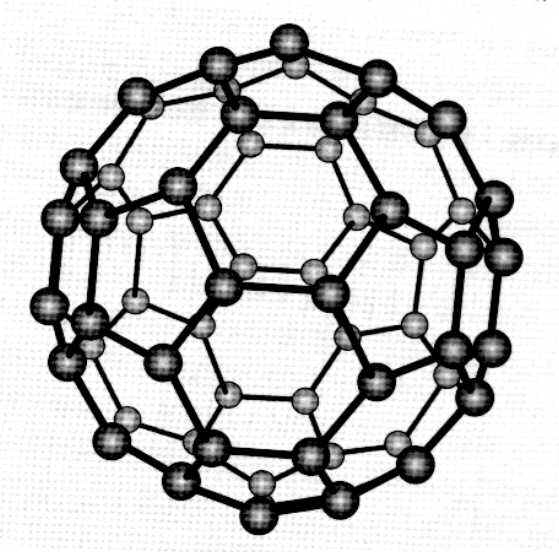
富勒碳(fullerenes)是指碳的同素异形体中的一大类,由五员碳环及六员碳环互相连线构成的封闭空心球状碳分子。富勒碳又称球碳、球苯、富勒烯、巴基球等,按谐音简称富勒可能最为便捷。富勒碳的着名代表是由20个六员环及12个五元环,相间分布、互相连线而成的60C,及由12个五员环和25个六员环构成的70C。
基本介绍
- 中文名:富勒碳
- 外文名:fullerenes
- 学科:冶金工程
- 领域:能源
- 範围:冶炼
- 别称:球碳
简介
富勒烯(Fullerene)是一种完全由碳组成的分子,中空,形状呈球型、椭球型、柱型或管状。本文主要从富勒碳的结构、性能、套用前景等方面来介绍富勒碳。富勒碳有C60、碳纳米管等结构,不同的富勒碳结构具有不同的性能和套用前景。
富勒烯(Fullerene) 是一种碳的同素异形体。任何由碳一种元素组成,以球状,椭圆状,或管状结构存在的物质,都可以被叫做富勒烯。富勒烯与石墨结构类似,但石墨的结构中只有六元环,而富勒烯中可能存在五元环。1985年Robert Curl等人製备出了C60。1989年,德国科学家Huffman和Kraetschmer的实验证实了C60的笼型结构,从此物理学家所发现的富勒烯被科学界推向一个崭新的研究阶段。1985年英国化学家哈罗德·沃特尔·克罗托博士和美国科学家理察·斯莫利在莱斯大学製备出了第一种富勒烯,即富勒烯分子。饭岛澄男早在1980年之前就在透射电子显微镜下观察到这样洋葱状的结构。自然界也是存在富勒烯分子的,2010年科学家们通过史匹哲太空望远镜发现在外太空中也存在富勒烯。 “也许外太空的富勒烯为地球提供了生命的种子”。在富勒烯的发现之前,碳的同素异形体的只有石墨、钻石、无定形碳(如炭黑和炭),它的发现极大地拓展了碳的同素异形体的数目。它具有极其特异的电化学特性、吸附气体特性以及机械和光学特性,因而受到世界各国科学界的高度重视。各国科学家正在尝试将它套用于医药、能源、化学、环保、电子、化妆品及机械等工业领域。
富勒烯的分类
富勒烯有以下分类:
巴基球团簇:最小的是C20 (二十烷的不饱和衍生物)和最常见的C60;
碳纳米管:非常小的中空管,有单壁和多壁之分;在电子工业有潜在的套用;
巨碳管:比纳米管大,管壁可製备成不同厚度,在运送大小不同的分子方面有潜在价值;
聚合物:在高温高压下形成的 链状、二维或三维聚合物。
纳米“洋葱”:多壁碳层包裹在巴基球外部形成球状颗粒,可能用于润滑剂;球棒相连二聚体:两个巴基球被碳链相连;富勒烯环。
富勒烯的结构
在数学上,富勒烯的结构都是以五边形和六边形面组成的凸多面体。最小的富勒烯是C20,有正十二面体的构造。没有22个顶点的富勒烯,之后都存在C2n的富勒烯,n=12、13、14……所有富勒烯结构的五边形个数为12个,六边形个数为n-10。
1.C60
C60是富勒烯家庭中相对最容易得到、最容易提纯和最廉价的各类,因此C60及其衍生物是被研究和套用最多的富勒烯。通过质谱分析、X射线分析后证明,C60的分子结构为球形32面体,它是由60个碳原子通过20个六元环和12个五元环连线而成的具有30个碳碳双键的足球状空心对称分子,所以,富勒烯也被称为足球烯。C60有1812种个异构体。
C60及其相关C70两者都满足这种所谓的孤立五角规则(IPR)。而C84的异构体中有24个满足孤立五角规则的,而其他的51568个异构体则不满足孤立五角规则,这51568 为非五角孤立异构体,而不满足孤立五角规则的富勒烯迄今为止只有几种富勒烯被分离得到,比如分子中两个五边形融合在顶尖的一个蛋形笼状内嵌金属富勒烯Tb3NaC84。或具有球外化学修饰而稳定的富勒烯如C50Cl10,以及C60H8。
2.C70
理论计算表明C70的LUMO轨道是一个二重简併轨道,不过它的LUMO+1轨道与LUMO轨道的能级差很小,因此它可以得到至少六个电子,常规的循环伏安和差示脉冲伏安法检测只能得到4个还原电势,而在真空条件下使用乙腈和甲苯的1:5的混合溶剂可以得到六个还原电势的谱图。
3.低对称性富勒烯
低对称性富勒烯的键长是不一样的,虽然也是离域π键,从核磁共振碳谱可以清楚看出来有很多条碳信号。
4.手性
一些富勒烯是D2对称性的,因此他们是有固有手性的,如 C76、C78、C80和C84等,科学家一直致力于发展特别的感测器来识别和分离他们的对映异构体。
富勒烯的性能
1.溶解性:富勒烯在大部分溶剂中溶得很差,通常用芳香性溶剂,如甲苯、氯苯,或非芳香性溶剂二硫化碳溶解。纯富勒烯的溶液通常是紫色,浓度大则是紫红色,C70的溶液比C60的稍微红一些,因为其他在500nm处有吸收;其他的富勒烯,如C76、C80等则有不同的紫色。富勒烯是迄今发现的唯一在室温下溶于常规溶剂的碳的同素异性体。
有些富勒烯是不可溶的,因为他们的基态与激发态的频宽很窄,如C28,C36和C50。C72也是几乎不溶的,但是C72的内嵌富勒烯,如La2@C72是可溶的,这是因为金属元素与富勒烯的相互作用。早期的科学科学家对于没有发现C72很是疑惑,但是却有C72的内嵌富勒烯。窄频宽的富勒烯活性很高,经常与其他富勒烯结合。
2.导电性:碳原子本具有导电性,而C60分子的导电性优于铜,重量只有铜的六分之一, 一个巴克球分子相当于一纳米,可谓极微小,它的导电性来自奇特的分子结构并非靠其他原子, 可见不久的将来人类世界将诞生非金属电缆、非金属电路板...等富勒烯产品
3.热力学性质:差示扫描量热法(DSC)表明C60在256K时发生相变,熵为27.3J.K−1.mol−1,归因于其玻璃形态-晶体转变,这是典型的导向无序的转变。相似地,C70在275K、321K和338K也发生无序转变,总熵为22.7 J.K−1.mol−1。富勒烯的宽的无序转变与从起始较低的温度的类跳跃式旋转向各向同性的旋转渐变有关。
4.化学性质
富勒烯是稳定的,但并不是完全没有反应性的。石墨中sp2杂化轨道是平面的,而在富勒烯中为了成管或球其是弯曲的,这就形成了较大的键角张力。当它的某些双键通过反应饱和后,键角张力就释放了,如富勒烯的[6,6]键是亲电的,将sp2杂化轨道变为sp3杂化轨道来减小键张力,原子轨道上的变化使得该键从sp2的近似120°成为sp3的约109.5°,从而降低了C60球的吉布斯自由能而稳定。富勒烯即可以形成单加成产物,也可以形成多加成产物。 富勒烯化学是研究富勒烯的化学性质的科学。功能化富勒烯从而调节其性质的需求促使人们在这个领域展开了大量的研究。例如,富勒烯的溶解度很差,而添加合适的官能团可以提高其溶解度。通过添加一个可以发生聚合的官能团,就可以获得富勒烯聚合物。富勒烯的功能化以分为两类:在富勒烯的笼外进行化学修饰;将分子束缚到富勒烯球内,也就是开孔反应。
5.周环反应:勒烯的[6,6]键可以与双烯体或亲双烯体反应,如D-A反应。[2+2]环加成可以形成四元环,如苯炔。偶极环加成反应可以生成五元环,被称作Prato反应。富勒烯与卡宾反应形成亚甲基富勒烯。
6.加氢(还原)反应:氢化富勒烯产物如C60H18、C60H36。然而,完全氢化的C60H60仅仅是假设产物,因为分子张力过大。高度氢化后的富勒烯不稳定,而富勒烯与氢气直接在高温条件下反应会导致笼结构崩溃,而形成多环芳烃。
7.氧化反应:富勒烯及衍生物在空气中会被慢慢的氧化,这也是通常情况下富勒烯需要在避光或低温中保存的原因。富勒烯与三氧化锇和臭氧等反应;与臭氧的反应很快很剧烈,可以生成羟基多加成的富勒醇混合物,因为加成数和加成位置有很宽的分布。
8.羟基化反应:富勒烯可以通过羟基化反应得到富勒醇,其水溶性取决于分子中羟基数的多少。一种方法是富勒烯与稀硫酸和硝酸钾反应可生成C60(OH)15,另一种方法是在稀氢氧化钠溶液的催化下反应由TBAH增加24到26个羟基。羟基化反应也有过用无溶剂氢氧化钠与过氧化氢和富勒烯反应的报导。用过氧化氢与富勒烯的反应合成C60(OH)8,羟基的最大数量,可以达到36至40个。
9.亲电加成:富勒烯也可以发生亲电反应,比如在富勒烯球外加成24个溴原子,最多亲电加成纪录保持者是C60F48。
10.配位反应:富勒烯的五元环和六元环可以作为金属配合物的配体,尤其是五元环,可以形成各种茂配合物。 [6,6]双键是缺电子的,通常与金属成键为η= 2(配位化学中的哈普托数)。键合模式如η= 5或η=6与球状富勒烯配体有关。阳光直接照射富勒烯和硫羰基钨W(CO)6的环己烷溶液生成(η2-C60)5 W(CO)6。
11.开孔反应:开孔反应是指通过化学手段选择性地切断富勒烯骨架上的碳碳键来製备开孔富勒烯的反应,开孔后就可能把一些小分子装到碳球中,如氢分子、氦、锂等。第一个开孔富勒烯是在1995由伍德等报导的。
12.碳纳米管
碳纳米管(英文Carbon Nanotube,缩写CNT)是在1991年1月由日本筑波NEC实验室的物理学家饭岛澄男使用高解析度分析电镜从电弧法生产的碳纤维中发现的。它是一种管状的碳分子,管上每个碳原子採取sp2杂化,相互之间以碳-碳σ键结合起来,形成由六边形组成的蜂窝状结构作为碳纳米管的骨架。每个碳原子上未参与杂化的一对p电子相互之间形成跨越整个碳纳米管的共轭π电子云。按照管子的层数不同,分为单壁碳纳米管和多壁碳纳米管。管子的半径方向非常细,只有纳米尺度,几万根碳纳米管并起来也只有一根头髮丝宽,碳纳米管的名称也因此而来。而在轴向则可长达数十到数百微米。
碳纳米管不总是笔直的,局部可能出现凹凸的现象,这是由于在六边形结构中混杂了五边形和七边形。出现五边形的地方,由于张力的关係导致碳纳米管向外凸出。如果五边形恰好出现在碳纳米管的顶端,就形成碳纳米管的封口。出现七边形的地方碳纳米管则向内凹进。
由于碳纳米管中碳原子採取sp2杂化,相比sp3杂化,sp2杂化杂化中s轨道成分比较大,使碳纳米管具有高模量、高强度。碳纳米管的硬度与金刚石相当,却拥有良好的柔韧性,可以拉伸。在工业上常用的增强型纤维中,决定强度的一个关键因素是长径比,即长度和直径之比。材料工程师希望得到的长径比至少是20:1,而碳纳米管的长径比一般在1000:1以上,是理想的高强度纤维材料。此外,碳纳米管的熔点是已知材料中最高的。在碳纳米管的内部可以填充金属、氧化物等物质,这样碳纳米管可以作为模具,首先用金属等物质灌满碳纳米管,再把碳层腐蚀掉,就可以製备出最细的纳米尺度的导线,或者全新的一维材料,在未来的分子电子学器件或纳米电子学器件中得到套用。有些碳纳米管本身还可以作为纳米尺度的导线。这样利用碳纳米管或者相关技术製备的微型导线可以置于硅晶片上,用来生产更加複杂的电路。利用碳纳米管的性质可以製作出很多性能优异的複合材料。碳纳米管还给物理学家提供了研究毛细现象机理最细的毛细管,给化学家提供了进行纳米化学反应最细的试管。碳纳米管上极小的微粒可以引起碳纳米管在电流中的摆动频率发生变化,利用这一点,可以製作能称量单个原子的“纳米秤”。
富勒烯及其衍生物物理性质的套用是多方面的。早在1991年,阿莱芒等人发现C60络合物可以在没有金属存在的情况下表现出铁磁性特徵,从而有希望开拓磁性记忆材料的一个新方向。用C60还能在CaAs晶体基质上製成C60-K3C60异质结膜,并可将其用于微电子器件等方面。随着研究的深入,富勒烯独特的物理性质将为其套用开闢一个广阔的领域。
富勒烯由于其独特的结构和化学物理性质,已对化学、物理、材料科学产生了深远的影响,在套用方面显示了诱人的前景。随着研究的不断深入,碳原子簇将要给人类带来巨大的财富。