中和反应(neutralization reaction)酸和硷互相交换成分,生成盐和水的反应。
酸+硷→盐+水
中和反应的实质是:H+和OH-结合生成水(H2O)。
基本介绍
- 中文名:中和反应
- 外文名:neutralization reaction
- 过程:酸和硷互相交换成分
- 概念:酸与硷作用生成盐和水的反应
- 实质:氢离子和氢氧根离子的结合
中和反应原理
 中和反应
中和反应溶于水后在水中被电离成自由移动的阴离子和阳离子。
例如HCl被电离成氢离子(H+)和氯离子(Cl-),而NaOH被电离成钠离子(Na+)和氢氧根离子(OH-)。氢离子和氢氧根离子结合成极难被电离的水,所以溶液中剩下的是钠离子和氯离子。
钠离子和氯离子在溶液中依然处于被电离的状态并不结合。但是生成物是NaCl。
酸与硷作用生成盐和水的反应,叫做中和反应
反应特徵
在酸硷滴定中的理论值和实际值总有相差,来看看这个:
当量点无法直接观察到,滴定时酸硷的强弱不同,达到滴定终点时溶液的酸硷性就不同,需选择适当指示剂使终点等于当量点,以作为判断标準.
指示剂的选择:
①强酸与强硷的中和滴定
当量点溶液的pH=酸硷滴定中三个重要的点:
当量点:酸的当量数=硷的当量数(二者正好完全反应)
终点:指示剂变色的点.
中和点:酸硷滴定过程中,容易恰成中性的点. 即pH=7
注意:(当量点才是恰好完全反应的点)
当量点不一定等于终点.
当量点不一定等于中性.7,这时既可选酚酞做指示剂,也可选甲基橙做指示剂.一般不用紫色石蕊试液做指示剂,因其颜色突变不明显.
②强酸与弱硷的中和滴定
当量点溶液显酸性,溶液pH<7,最好选甲基橙、甲基红做指示剂,一般不选酚酞试液做指示剂.因为酚酞溶液遇酸不变色。
③弱酸与强硷的中和滴定
当量点溶液显硷性,pH>7,这时最好选酚酞做指示剂,一般不选甲基红和甲基橙做指示剂.
酸硷反应产生热量:
强酸强硷反应,1mol氢离子与1mol氢氧根离子反应,△H=-57.3KJ
反应式
酸+硷
NaOH+HCl=NaCl+H2O氢氧化钠(俗称烧硷、火硷、苛性钠)可以和盐酸发生中和反应,生成氯化钠和水。
2NaOH+H2SO4=Na2SO4+2H2O氢氧化钠可以和硫酸发生中和反应,生成硫酸钠和水.
NaOH+HNO3=NaNO3+H2O氢氧化钠可以和硝酸发生中和反应,生成硝酸钠和水
Ca(OH)2+2HCl=CaCl2+2H2O氢氧化钙可以与盐酸发生中和反应,生成氯化钙和水,反应放出大量热。
Al(OH)3+3HCl=AlCl3+3H2O氢氧化铝可以和盐酸发生中和反应,生成氯化铝和水,治疗胃酸过多的胃药的主要成分就是氢氧化铝
Ba(OH)2+2HCl=BaCl2+2H2O氢氧化钡和盐酸发生中和反应,生成氯化钡和水。
Fe(OH)3+3HCl=FeCl3+3H2O氢氧化铁(Fe(OH)3)不溶于水,但是也能和盐酸发生中和反应,生成三氯化铁和水。
KOH+HI=KI+H2O氢氧化钾和氢碘酸发生中和反应,生成碘化钾和水。
Cu(OH)2+H2SO4=CuSO4+2H2O氢氧化铜和硫酸发生中和反应,生成硫酸铜和水。
由此可见,酸和硷作用,生成盐和水的反应是中和反应。中和反应属于複分解反应。但是,酸和硷之间发生的不一定是中和反应,例如:
2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O氢氧化钴(III)和盐酸发生氧化还原反应,生成氯化钴(II)、氯气和水,反应放热,溶液转为粉红色。
2Ni(OH)3+6HCl=2NiCl2+Cl2↑+6H2O氢氧化镍(III)和盐酸发生氧化还原反应,生成氯化镍(II)、氯气和水,反应放热,溶液转为碧绿色。
由于三价的钴、镍有氧化性,能把盐酸氧化,生成氯气,所以这类反应不属于中和反应。同理,氢氧化亚铁和硝酸的反应也不属于中和反应。
酸性氧化物+硷
Ca(OH)2+Co2=CaCO3↓+H2O澄清石灰水和二氧化碳发生中和反应,生成碳酸钙沉澱和水,石灰水变浑浊。
2NaOH+CO2=Na2CO3+H2O氢氧化钠(俗称烧硷、火硷、苛性钠)和二氧化碳发生中和反应,生成碳酸钠和水。
硷性氧化物+酸
Na2O+H2SO4=Na2SO4+H2O氧化钠和硫酸发生中和反应,生成硫酸钠和水
CaO+2HCl=CaCl2+H2O生石灰和盐酸发生中和反应,生成氯化钙和水
酸性氧化物+硷性氧化物
Na2O+CO2=Na2CO3氧化钠和二氧化碳发生中和反应,生成碳酸钠
实际套用
土壤的酸硷性
在土壤里,由于有机物在分解的过程中会生成有机酸,矿物的风化也可能产生酸性物质,空气污染造成酸雨,也会导致一些地方的土壤呈酸性,这些都不利于作物的生长。施用适量的硷,能中和土壤里的酸性物质,使土壤适合作物生长,并促进微生物的繁殖。土壤中的钙离子增加后,能促使土壤胶体凝结,有利于形成团粒,同时又可供给植物生长所需的钙元素。
处理工厂废水
厂里的废水常呈现酸性或硷性,若直接排放将会造成水污染,所以需进行一系列的处理。硷性污水需用酸来中和,酸性污水需用硷来中和,如硫酸厂的污水中含有硫酸等杂质,可以用熟石灰来进行中和处理。生成硫酸钙沉澱和水。
用于医药卫生
人的胃液呈酸性,主要是盐酸,当胃液的pH值为0.8~1.5时,有助于食物的消化.如果胃酸过多就会使人感到不适,这时医生就会让你口服一些硷性药物,使硷与胃酸反应生成无毒的中性物质.用含氢氧化铝的药片治疗胃酸过多,生成氯化铝和水。如胃药中含有Al(OH)3以中和胃酸,Al(OH)3+3HCl==AlCl3+3H2O
被蚊虫叮咬后可在患处涂含有硷性物质(如NH3·H2O氨水)的药水(蚊虫能分泌出蚁酸)
溶液酸硷性
在科学实验室里,经常要把溶液的pH控制在一定的範围内,如果溶液的酸性或硷性太强,就可以用适当的硷或酸调节溶液的pH
厨房中的套用
松花蛋中含有硷性物质,人们在食用它时常加一些醋,以中和其硷性,使松花蛋美味可口:在蒸馒头时,人们在经过发酵的麵粉里加一些纯硷,以中和发酵产生的酸,这样蒸出的馒头鬆软可口。
检测反应
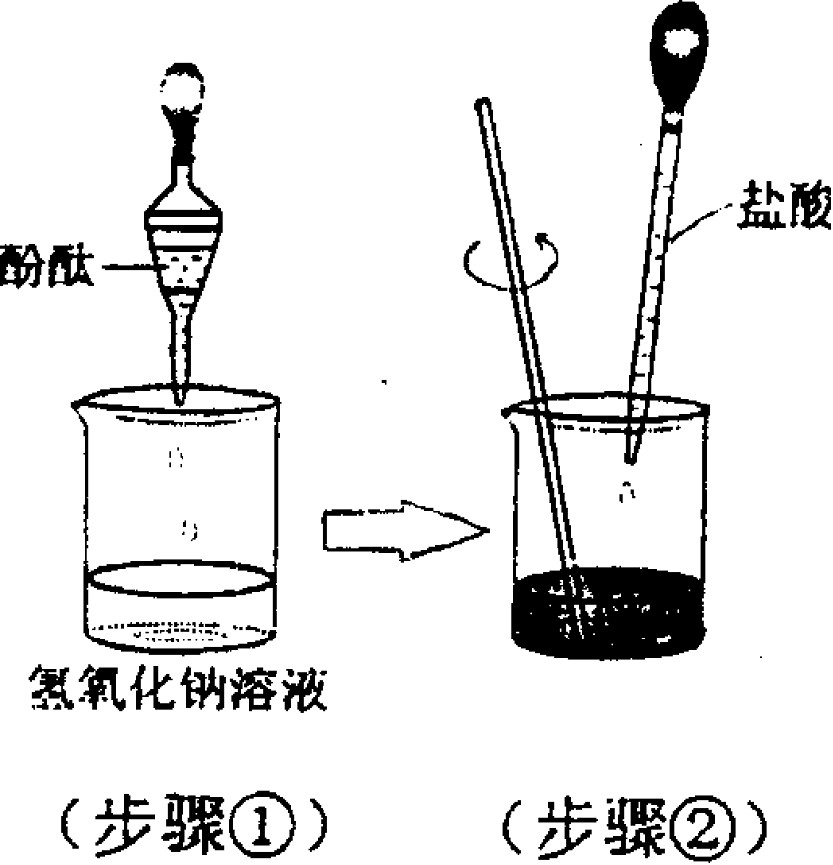
用酚酞溶液
在反应前将酚酞溶液滴入硷性反应物中,溶液呈红色。缓慢滴入另一反应溶液,在中和反应进行到恰好完全反应,观察到溶液的红色消失。这可说明中和反应的进行,也可以说明反应的完全。但是不可说明是否滴入过多的酸性溶液而使试液呈酸性。(酚酞溶液无法使酸性溶液显色)
pH试纸
一般在中和反应进行时,反应前后溶液的pH会变化。用pH来检测中和反应是否进行是最直接的方式。pH试纸主要有广泛试纸和精密试纸。
探测温度
一般来说,中和反应都是放热的反应。但有很多反应都是放热反应而不是中和反应,如硫氰酸钾被氧化出硫氰的反应。
酸硷指示剂
将酸硷指示剂放入溶液中,酸硷指示剂的颜色会随着两种溶液的pH值变化这是最直接的方法。常见的酸硷指示剂有无色酚酞(遇硷变红,但遇到浓度高的强硷时变成无色,原因是结构改变)、紫色石蕊(酸红硷蓝)、溴百里酚蓝、甲基橙等。

