上皮细胞-间充质转化(EMT),是指上皮细胞通过特定程式转化为具有间质表型细胞的生物学过程。在胚胎髮育、慢性炎症、组织重建、癌症转移和多种纤维化疾病中发挥了重要作用,其主要的特徵有细胞黏附分子(如E-钙黏蛋白)表达的减少、细胞角蛋白细胞骨架转化为波形蛋白(Vimentin)为主的细胞骨架及形态上具有间充质细胞的特徵等。通过EMT,上皮细胞失去了细胞极性,失去与基底膜的连线等上皮表型,获得了较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力等间质表型。EMT是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程。阐明调控恶性肿瘤细胞发生EMT过程的分子机制,明确其在恶性肿瘤的发生、发展、转移中的病理意义,并探索基于EMT关键分子的诊断方法及靶向EMT关键分子的治疗手段是肿瘤转移中EMT机制研究的关键科学问题。
基本介绍
- 中文名:上皮间充质转化
- 外文名:Epithelial-Mesenchymal Transition
- 简称:EMT
- 亚型:3种
分类
在2007年举行的国际EMT会议和2008年冷泉港(Cold Spring Harbor)实验室会议上,以EMT发生的特定生物学环境为依据将其分为。
1型
与胚胎植入、发育和器官形成相关的EMT称为1型EMT。其主要生物学功能是通过间充质细胞上皮化(MET)过程产生次级上皮细胞,实现胚胎形成过程中的细胞类型多样化。
2型
与损伤修复、组织再生和器官纤维化相关的EMT被定义为2型EMT。其主要生物学作用是通过产生纤维细胞以修复由创伤和炎症反应造成的组织损伤。生理状态下,当炎症反应缓解后该转化过程即自行停止;然而在炎症反应持续活化的情况下,EMT过程也将持续存在,并最终造成器官纤维化。
3型
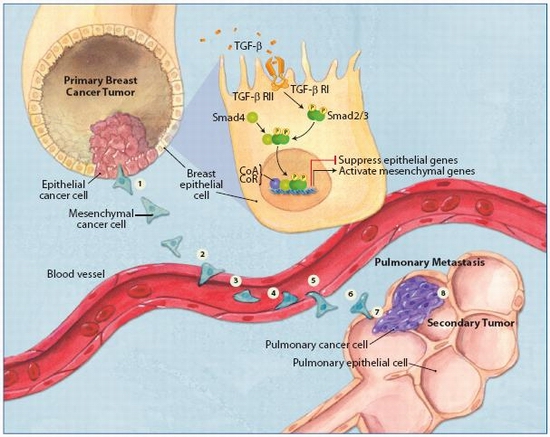
3型EMT是指与上皮细胞恶性肿瘤相关的表型转化。原发性上皮组织肿瘤细胞通过3型EMT形成具有迁移能力的间充质细胞,随血流转移至不同部位,进而通过EMT过程形成上皮细胞的肿瘤转移灶。与1型和2型EMT所形成的完全丧失上皮细胞表型的间充质细胞不同的是,3型EMT形成的转移性肿瘤细胞在获得间充质表型的同时保持一定的上皮细胞的特性。
信号转导通路
1型
Wnts和Notch信号通路。
细胞表面蛋白(E-cadherin↓ N-cadherin↑)
2型
炎症反应造成的肾脏损伤由其募集的多种类型细胞所介导,其中主要包括巨噬细胞和活化的成纤维细胞。上述细胞通过释放大量生长因子、趋化因子和基质蛋白酶,活化包括Smads通路、ERK-MAPK通路、PI3K-AKT通路在内的多条信号转导径路启动2型EMT。
细胞骨架蛋白(成纤维特异性蛋白1,FSP1),细胞表面蛋白(E-cadherin↓ OB-cadherin↑),细胞外基质蛋白(层连蛋白↓ 纤连蛋白↑)
3型
在原发肿瘤的形成过程中,主要存在5条信号通路,包括酪氨酸激酶受体径路、整合素径路、Wnts径路、NF-kB径路和TGF-b径路(涉及smads/AKT/GSK3/Rho-GTP酶等信号分子)。
转录因子:Snail因子,特别是Snail1和Snail2的上调錶达可以作为3型EMT的共同生物标誌物。
Twist在早期的胚胎形成、组织纤维化和肿瘤转移过程中也存在上调錶达。在3型EMT形成的转移性恶性肿瘤细胞中,Twist具有独立的抑制E钙粘蛋白表达并上调纤连蛋白和N钙粘蛋白的作用。
MicroRNA(miR200s,miR205等)
研究进展
上皮间充质转化,特别是3型上皮间充质转化近年研究较热。由于上皮性肿瘤在恶性肿瘤中所占比例及其转归预后较差,探究上皮细胞在获得去分化迁移侵袭能力的过程,即上皮间充质转化过程,为肿瘤的控制提供了方向。
E-cadherin
细胞在上皮间充质过程中上皮极性和细胞连线缺失,经研究证实,E-cadherin可维持细胞间紧密连线,阻止细胞活动侵袭及转移扩散。相反地,培养的上皮细胞E-cadherin转基因小鼠模型或表达敲出证实了低E-cadherin表达可诱导EMT发生。Cadherin的表达可以在转录、翻译、翻译后蛋白降解等多水平进行调节,在不同的人体肿瘤中,E-cadherin的功能缺失可由基因突变产生的蛋白异常、异常的转录后修饰(磷酸化或糖基化)和增加的蛋白水解所致。例如,转录因子Snail-1,Snail-2,Zeb-1,Zeb-2,Twist的影响;启动子超甲基化所致转录水平沉默等。
zeb1
zeb1作为EMT最关键的转换分子 ,其表达可以抑制mir-200b/a/429,而mir-200b/a/429也可以做为抑制因子抑制zeb1的表达。
microRNA
microRNA是进化过程中高度保守的长度在19-24个核苷酸的RNA分子,它能够通过与mRNA的特异性结合,在转录后水平影响基因表达。据估计miRNA能顾影响人体内30%的蛋白表达。在肿瘤发生过程中,miRNA可以通过自身的上调和下调分别行使原癌基因和抑癌基因的作用。它也可影响肿瘤细胞对于细胞抑制剂或辐射的敏感性。
上皮间充质转化中miRNA的複杂调节可以通过miR-200家族(miR-200a,miR-200b,miR-200c,miR-141及miR-429)的例子来阐明。miR-200家族抑制转录因子Zeb-1和Zeb-2(E-cadherin的转录因子)的表达,相反地,Zeb-1和Zeb-2抑制miR-200的表达。换言之,miR-200通过反馈调节抑制EMT过程。也有研究证实,在人类乳腺癌细胞系,miR-200上调促进转移,提示在细胞转移过程不同进程中,miR-200成员发挥的作用不同。并且,Notch配体Jagged2通过抑制转录因子GATA3的表达促进肿瘤转移,GATA3也可抑制miR-200进而促进肿瘤转移,故言之,miR-200与GATA3也属于反馈抑制调节。
miR-9也可直接影响E-cadherin的表达。部分miRNA可通过靶向EMT中的转录因子,例如Snail,Zeb等,或调节其中信号通路影响肿瘤转移。举例说明,抑癌基因p53可诱导miR-34a和miR-192的表达,进而抑制Snail-1和Zeb-2的表达,阻止EMT进程。miR-138可抑制ZEb-2进而抑制EMT。miR-194抑制Bmi,而Twist-1诱导Bmi活化EMT。miR-27直接阻断肿瘤抑制基因APC的表达,进而促进EMT。
最新展望
考虑到在肿瘤迁移和侵袭过程重要性,EMT是肿瘤转化瀑布中重要的一步。儘管目前对于EMT机制理解已经有了进展,目前,我们还未研製出完善地EMT靶向肿瘤治疗药物。抑制血管内皮生长因子受体(EGFR)活性药物(匹配依赖性上调EGFR的肿瘤类型)已投入临床套用,但其效果尚未完成特异性评估,并且,此类药物往往也会走向复发的最终结局。靶向针对EMT过程中不同的受体(包括血管内皮生长因子受体EGFR,胰岛素样生长因子1型受体IGF1R,PDGFR,FGFR等)赖氨酸激酶活性的新型药物,尚处于I期临床试验或者临床前测试中。这类研究中的主要问题在于,目前缺乏治疗过程中对于肿瘤转移的特异性无创伤标记。我们相信,对于EMT和肿瘤转移的研究将会为恶性肿瘤治疗开闢新的视野。