泡佩克斯图其实就是“电位一pH图"。能斯特方程式主要说明E与电极材料、参加反应的各物种的浓度、温度的关係.然而,在许多情况下月还与溶液的酸度(pH值)有关。泡佩克斯图就是用来讨论电对的氧化还原性与酸性之间的关係。可以这样描述泡佩克斯图:它是关于电对的电极材料—参加反应各物种浓度—温度—溶液酸度的关联图。
基本介绍
- 中文名:泡佩克斯图
- 外文名:Application of Pourbaix Map
- 发现:Pourbaix
- 学科:化学
- 套用领域:地质科学、湿法冶金等
- 特点:直观易懂、概括全貌、使用方便
泡佩克斯
泡佩克斯(M.Pourbaix)是国际知名的腐蚀和电化学科学家。他在化学热力学领域的杰出工作为电化学,特别是金属腐蚀科学奠定了重要的理论基础。英国剑桥大学U.R.Evans将其发明的电位一PH图对腐蚀电化学的贡献与微分方程对数学的贡献相提并论。
由于他的杰出贡献,使他获得了腐蚀科学和电化学方面几乎所有的重要国际大奖,如OlinPalladium奖、U.R.Evans奖。曾任比利时自由大学教授,IUPAC电化学委员会及国际腐蚀理事会ICCO主席,Electrochemica Acta谘询委员会会员、Corrosion Science编委等职。1990年,美国腐蚀工程师学会建立了“泡佩克斯奖学金",1996年,国际腐蚀理事会建立了“国际合作泡佩克斯奖”。
泡佩克斯图简介
泡佩克斯(Pourbaix)图其实就是“电位一pH图”。1938年,Pourbaix首先根据Nernst方程式和物种在水溶液中的性质创製了第一幅电位一pH图,后用热力学数据,又结合金属氧化物和氢氧化物的溶解度即有关反应的平衡常数绘製了90种元素和水构成的电位一pH图,使之成为了一部大型电位一pH图图集。泡佩克斯图亦叫“物质优势範围图”或“优势区相图”。这种图是电化学热力学分析的结果,在金属腐蚀、电化学、无机化学、分析化学、地质科学、湿法冶金等方面都得到了广泛套用。由于该图直观易懂、概括全貌、使用方便,所以深受工程人员的欢迎。
套用泡佩克斯图可以一目了然地看出在一定pH和E下,某元素不同氧化态在水溶液体系平衡时的稳定区;当不同物质相互反应时也可以反映出平衡条件和发生反应的趋势。但该图是以热力学数据为基础,没有涉及反应速率,即动力学问题,而且金属表面的pH值和溶液内部的pH值也有一定的差别,所以泡佩克斯图仅是一种近似的处理。所以套用泡佩克斯图讨论水溶液体系中的一些实际问题时,还必须进一步从动力学去考察,才能得到满意的结果,以便预测和分析问题。
泡佩克斯图的性质
在泡佩克斯图曲线上的每一个点都表示电极反应在一定条件下(浓度、酸度)达到平衡时,电位与pH之间的关係,所以也称为“优势区相图”。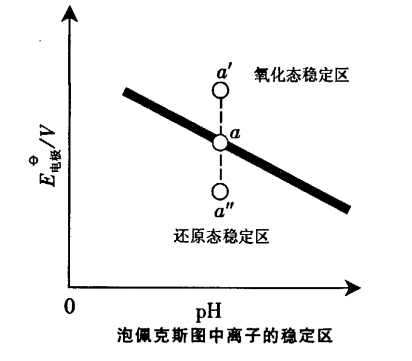 图1
图1
 图1
图1如图1所示,当物种离子浓度改变,“氧化态”、“还原态”的浓度就要改变。电位随着改变,新的平衡点就要移动(或上或下),造成了直线上方为氧化态的稳定区、下方为还原态的稳定区。
Lewis酸硷的泡佩克斯图
泡佩克斯图不仅可用来讨论电对的氧化还原性与Bmsted酸性之间的关係,而且对Lewis酸硷之间的氧化还原化学反应也具有重要的指导意义。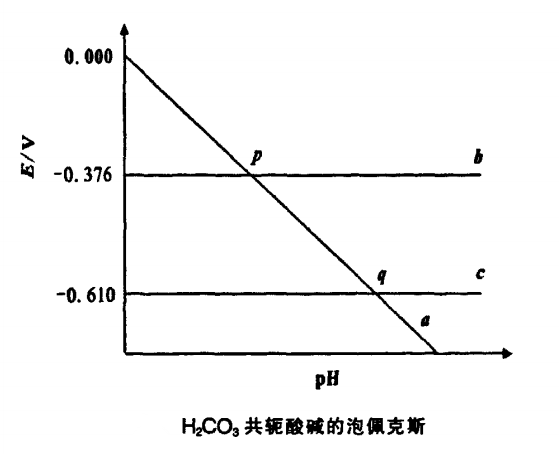 图2
图2
 图2
图2Lewis酸是指能接受电子对的分子、离子或原子团,Lewis硷是指能给出电子对的分子、离子或原子团。Lewis酸硷之间的反应包括了除普通氧化还原反应以外的所有反应。广义氧化还原反应是指在反应中电子波函式发生了改变的反应,也就是在反应中核外邻近区内价电子出现机率发生了改变的反应。Lewis酸硷反应既然是电子对给出和接受的反应,那幺价电子在核外的机率分布必然发生改变,因此Lewis酸硷反应也是广义氧化还原反应。
龚兆胜等人认为,任何溶液中的Lewis酸硷反应都是广义氧化还原反应。只要是溶液中有酸硷参加的广义氧化还原反应,都可以得出Lewis酸硷的电势一pH图。
以H2CO3为例制出其泡佩克斯图(图2),可直观地获得H2CO3和HCO3-不发生离解的条件。H2CO3和HCO3-的氧化还原性的强弱,HCO3-和CO32-的水解方向等信息。
泡佩克斯图的套用
判断氧化还原反应进行的方向和顺序
用泡佩克斯图判断氧化还原反应进行的方向和顺序,与用表列标準电极电位判断的原理和方法相同,但前者直观、全面因为它可以直接判断不同浓度和酸度条件下反应进行的方向和顺序加图3所示。 图3
图3
 图3
图3(1)同一pH值时,位于上面直线的氧化态可与下面直线的还原态物种起反应,也有表列之“对角线规律” ;
(2)直线之间的距离就是两个电极组成的电池的电动势,两条直线之间的距离越大坷越大,△G越负,则反应自发进行的趋势越大;
(3)对同时存在的几个反应,氧化还原反应进行的顺序可按直线之间距离的大小排列。
解释天然水的化学行为
水与空气接触时被O2饱和,其中许多物种都可被这种强氧化剂所氧化。缺氧条件下(特别是作为还原剂的有机物存在时)可发现更多的还原性物种。控制天然水pH,其主要体系是CO2—H2CO3一HCO3-—CO32-双质子体系,酸和硷分别来源于大气中CO2和溶解的碳酸盐。生物过程也十分重要:呼吸作用消耗O2并放出CO2这个酸性氧化物使pH下降从而还原电位更负;相反的过程(光合作用)消耗CO2并放出O2,酸的消耗使pH上升从而使还原电位负值减小。图4给出了有代表性的天然水的pH值和存在与水中的氧化还原电对的电位。 图4
图4
 图4
图4在有色重金属冶炼过程中,例如在湿法冶金中的浸出、净化、电解。火法冶金中的洗涤蒸馏冷凝炉气等操作。往往产生含有一系列重金属离子的废水。废水中特别是Cu2+、Cd2+、Pb2+、Hg2+、As3+等都是有毒的,直接排放到大河、田野将给水体和农田造成严重污染。因此废水在排放前都得进行深度净化,使重金属离子的含量达到允许浓度以下。而在污水处理中,金属一水泡佩克斯图有着重要意义。
在水溶液中金属防腐的套用
(1)电化学腐蚀
当金属中含有比它不活泼的杂质,并与电解质溶液(在潮湿空气中,金属表面吸附一层水膜,其中溶有O2、CO2等,起着电解质溶液的作用)接触时,就形成了原电池,这时活泼金属为负极(即阳极),杂质为正极(即阴极),因此活泼金属遭受腐蚀.由于电化学作用引起的腐蚀称为电化学腐蚀。例如,钢铁中含石墨、Fe,C等不活泼杂质,在潮湿空气中,就在钢铁表面形成无数微电池.此时,Fe为阳极,不活泼杂质为阴极,因此,钢铁遭受腐蚀。
(2)金属的防腐
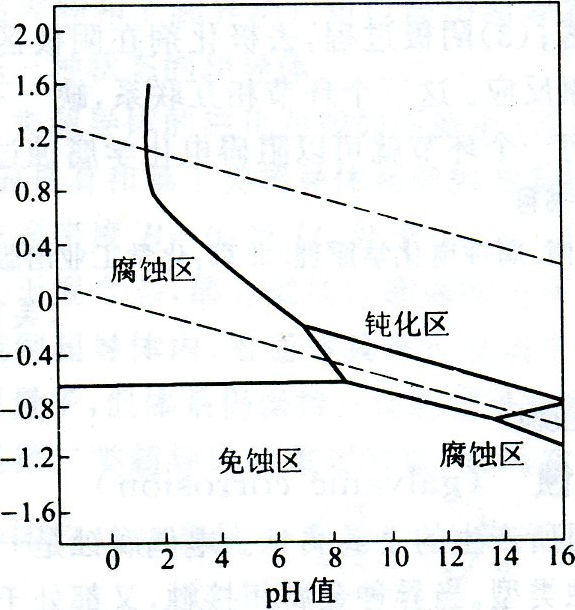
金属防腐的方法很多。有对金属进行涂、衬、渗、镀,或改变金属的组成以及处理周围的介质进行电化学保护等。若从泡佩克斯图来看,可以採取三种方法:
1)把金属的E降低到平衡线以下落入非腐蚀区此时。处于热力学稳定态可以免受腐蚀.一般採用阴极保护法,将进金属与电源负极相连或在金属片上联接一种E比该金属更负更活泼的金属,使该金属成为阴极而不遭受腐蚀。
2)把金属的E升高而进入钝化区,由于金属表面生成了难溶的、緻密的保护膜,也可使金属的腐蚀大大减轻。通常採用阳极保护法,将该金属与电源正极相连,或在溶液中加入阳极缓蚀剂,或用氧化剂使金属金属表面产生钝化膜。
3)使溶液的pH适当升高,也可以在表面形成钝化膜。大约在pH=9.0—13.0的範围内可以生成氢氧化物的钝化膜。因此,防止金属在工业用水中的腐蚀,常常加入少量硷。使水的pH=9.0—13.0之间(因为,pH>14有些金属可能转化为含氧酸盐而溶解,所以,金属在强硷性溶液中又将遭受腐蚀,称为金属的苛性脆裂),以减轻金属的腐蚀。