构造原理,是化学中的一种定理,决定了原子、分子和离子中电子在各能级的排布。随核电荷数递增,大多数元素的电中性基态原子的电子按顺序填入核外电子运动轨道,即为构造原理。
基本介绍
- 中文名称:构造原理
- 英文名称:aufbau principle
- 套用学科:化学(一级学科)
原理简介
构造原理认为全部电子是一个一个地依次进入电场,并假设对电场而言它们是处于最稳定的情况中。它是在1920年前后由尼尔斯·玻尔正式提出,主要是以量子力学描述。
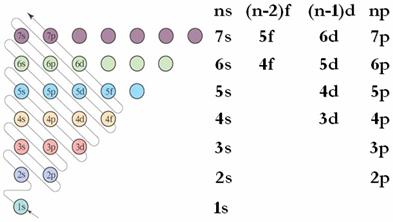
右图中,每个小圆圈表示一个能级。每一行对应一个能层,各圆圈连线的顺序表示随核电荷数递增而增加的电子填入能级的顺序。
根据构造原理,可以将各能级按能量的差异分成能级组,如右图所示。每一行表示一个能级组,自下而上表示n个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。
详细内容
科学家归纳大量的光谱事实得出如下结论:构想从氢原子开始,随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,大多数元素的电中性基态原子的电子按顺序填入核外电子运动轨道,叫做构造原理(aufbau principle)
某些特殊原子,外部构造呈现半满,因为半满时原子结构更加稳定。比如:Au Ag原子等。
特别注释
aufbau是德文“构造”。所谓“随电荷递增电子填入轨道”,是一种象形的说法,是一种思维模式,事实上单独地考察某一个多电子原子的电子在原子核外排布是并没有先后填入的次序。
对于同一能级,当电子排布为全充满(d10,如29号元素Cu铜)或半充满(d5、f7)、全空(如46号元素Pd钯)时,能量较为稳定。
根据构造原理,绝大多数基态原子核外电子的排布都遵循下列顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d......
原子核外电子按能量由低到高的顺序依次排布。因此,根据构造原理可以比较各能级的能量高低。
原子的核外电子不是完全按照能层顺序依次排布的,即不完全是排满n能层后再排(n+1)能层,而是按照上图所示的能级顺序排布的,在该顺序中,从第三能层开始,出现了能级交错现象,该能级顺序就是能量由低到高的顺序。
