酸硷滴定法是指利用酸和硷在水中以质子转移反应为基础的滴定分析方法。
可用于测定酸、硷和两性物质,是一种利用酸硷反应进行容量分析的方法。用酸作滴定剂可以测定硷,用硷作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。最常用的酸标準溶液是盐酸,有时也用硝酸和硫酸。标定它们的基準物质是碳酸钠。
基本介绍
- 中文名:酸硷滴定法
- 外文名:acid-base titration
- 氢氧化钠:常用的硷标準溶液
- 缺点:精确度不高
- 误差:约为1%
- 学科:无机化学
酸硷滴定法的基本原理
强酸强硷的滴定
强酸和强硷相互滴定的滴定反应为:以NaOH液(0.1000mol/L)滴定20.00ml HCl液(0.1000mol/L)为例,滴定曲线如下图: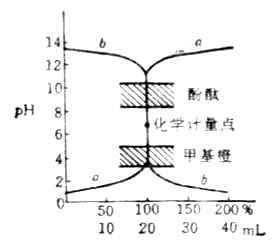 NaOH与HCL的滴定曲线
NaOH与HCL的滴定曲线
 NaOH与HCL的滴定曲线
NaOH与HCL的滴定曲线滴定开始前 pH=1.00
滴入NaOH液19.98ml时 pH=4.30
化学计量点时 pH=7.00
滴入NaOH液20.02ml时 pH=9.70
从滴定曲线可以看出:
(1)根据滴定突跃选择指示剂。滴定曲线显示,滴定突跃(在计量点附近突变的pH值範围)範围很大,为4.30~9.70,凡是变色範围全部或部分落在滴定突跃範围内的指示剂都可以用来指示终点,所以酸性指示剂(甲基橙、甲基红)和硷性指示剂(酚酞)都可以用来指示强硷滴定强酸的滴定终点。
(2)选择滴定液的浓度。浓度大,突跃範围宽,指示剂选择範围广;但是,浓度太大,称样量也要加大,所以一般使用0.1mol/L浓度的滴度液。
强硷滴定弱酸
滴定反应为:
以NaOH液(0.1000moL/L滴定20.00ml醋酸(HAc,0.1000mol/L)为例,滴定曲线如下图: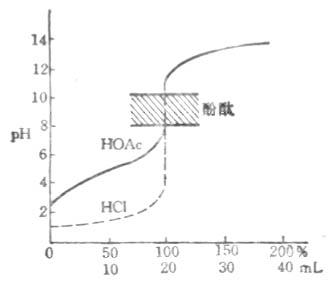 用NaOH滴定HOAc的滴定曲线
用NaOH滴定HOAc的滴定曲线
 用NaOH滴定HOAc的滴定曲线
用NaOH滴定HOAc的滴定曲线滴定开始前 pH=2.88
滴入NaOH 液19.98ml时 pH=7.75
化学计量点时 pH=8.73
滴入NaOH液20.02ml时 pH=9.70
从滴定曲线可以看出:
(1)只能选择硷性指示剂(酚酞或百里酚酞等),不能选用酸性範围内变色的指示剂(如甲基橙、甲基红等)。因为突跃範围较小,pH值在7.75~9.70之间;计量点在硷性区。
(2)弱酸被準确滴定的判决是C·Ka>10-8。因为Ka愈大,突跃範围愈大。而Ka<10-8时,已没有明显突跃,无法用指示剂来确定终点;另外,酸的浓度愈大,突跃範围也愈大。
强酸滴定弱硷
滴定反应为:
以HCl液(0.1000mol/L)滴定20.00mlNH3·H2O液(0.1000mol/L)为例,滴定曲线如下图:
滴定开始前 pH=11.12
滴入HCl 液19.98ml时 pH=6.24
化学计量点时 pH=5.27
滴入HCl液20.02ml时 pH=4.30
从滴定曲线可以看出:
(1)只能选择酸性指示剂(甲基橙或溴甲酚绿),不能选用硷性範围内变色的指示剂(酚酞)。
(2)弱硷被準确滴定的判决是C·Kb>10-8。
方法简介
最常用的硷标準溶液是氢氧化钠,有时也用氢氧化钾或氢氧化钡,标定它们的基準物质是邻苯二甲酸氢钾KHC8H4O6或草酸H2C2O·2H2O: 滴定曲线
滴定曲线
 滴定曲线
滴定曲线OHˉ+HC8H4O6ˉ→C8H4O6ˉ+H2O如果酸、硷不太弱,就可以在水溶液中用酸、硷标準溶液滴定。离解常数Ka和Kb是酸和硷的强度标誌。当
酸或硷的浓度为0.1Μ,而且Ka或Kb大于10-7时,就可以準确地滴定,一般可準确至0.2%(见滴定误差)。多元酸或多元硷是分步离解的,如果相邻的离解常数相差较大,即大于104,就可以进行分步滴定,这种情况下準
精确度不高,误差约为1%。 盐酸滴定碳酸钠分两步进行:
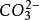
HCO3ˉ+H﹢→CO2↑+H2O相应的滴定曲线上有两个等当点,因此可用盐酸来测定混合物中碳酸钠和碳酸氢钠的含量,先以酚酞(最好用甲酚红-百里酚蓝混合指示剂)为指示剂,用盐酸滴定碳酸钠至碳酸氢钠,再加入甲基橙指示剂,继续用盐酸滴定碳酸氢钠为二氧化碳,由前后消耗的盐酸的体积差可计算出碳酸氢钠的含量。 酸硷滴定法
酸硷滴定法
 酸硷滴定法
酸硷滴定法某些有机酸或有机硷太弱,或者它们在水中的溶解度小,因而无法确定终点时,可选择有机溶剂为介质,情况就大为改善。这就是在非水介质中进行的酸硷滴定(见非水滴定)。
有的非酸或非硷物质经过适当处理可以转化为酸或硷。然后也可以用酸硷滴定法测定之。例如,测定有机物的含氨量时,先用浓硫酸处理有机物,生成NH3,再加浓硷并蒸出NH3,经吸收后就可以用酸硷滴定法测定,这就是克氏定氮法。又如测定海水或废水中总盐量时,将含硝酸钾、氯化钠的水流经阳离子交换柱后变成硝酸和盐酸,就可以用标準硷溶液滴定。
套用意义
酸硷滴定法在工、农业生产和医药卫生等方面都有非常重要的意义。三酸、二硷是重要的化工原料,它们都用此法分析。在测定製造肥皂所用油脂的皂化值时,先用氢氧化钾的乙醇溶液与油脂反应,然后用盐酸返滴过量的氢氧化钾,从而计算出1克油脂消耗多少毫克的氢氧化钾,作为製造肥皂时所需硷量的依据。又如测定油脂的酸值时,可用氢氧化钾溶液滴定油脂中的游离酸,得到 1克油脂消耗多少毫克氢氧化钾的数据。酸值说明油脂的新鲜程度。粮食中蛋白质的含量可用克氏定氮法测定。很多药品是很弱的有机硷,可以在冰醋酸介质中用高氯酸滴定。测定血液中HCO的含量,可供临床诊断参考。
套用实例
(1)重铬酸钾法测铁
试样→热HCl溶解→SnCl2还原→钨酸钠(指示剂)→TiCl3还原(过量)→加Cu2+(催化剂)→加水→加入H2SO4+H3PO4混酸→加二苯胺磺酸钠(滴定指示剂)→用K2Cr2O7标準溶液滴定→终点(绿色→紫色)加入H3PO4的主要作用:
(1)Fe3+生成无色Fe(HPO4)2-络离子,使终点容易观察;
(2)降低铁电对电位,使指示剂变色点电位更接近等当点电位重铬酸钾法测定铁是测定矿石中全铁量的标準方法。
(2)废水中有机物的测定
化学耗氧量(COD) 是衡量水污染程度的一项指标,反映水中还原性物质的含量,常用K2Cr2O7法测定。
测定方法:在水样中加入过量K2Cr2O7溶液,加热回流使有机物氧化成CO2,过量K2Cr2O7用FeSO4标準溶液返滴定,用亚铁灵指示滴定终点。本方法在银盐催化剂存在下,直链烃有85~95%被氧化,芳烃不起作用,因此所得结果不够严格。

