过渡金属促进的C-C键活化反应近年来引起了较大的兴趣。醇是一类很常用的反应底物,可以通过β-C消除来实现C-C键活化,继而发生后续的转变。但醇类的C-C活化仍然较为困难,条件较为苛刻。如果能在醇类底物中引入额外的合适基团与过渡金属进行配位,则有望稳定反应中的关键C-C活化过渡态/中间体,从而实现较为温和的反应。
基本介绍
- 中文名:逆羟醛缩合
- 对应:羟醛缩合
- 套用1:C-C键活化
- 套用2:α-芳基化反应
- 领域:有机合成
逆羟醛缩合实现C-C键活化及在α-芳基化反应
江南大学的张松林课题组报导了一个利用逆羟醛缩合反应实现β-羟基羰基化合物的C-C活化,并与卤代芳烃偶联得到α-单芳基化的酮和酯(J.Org.Chem.2016,81,57-65)。反应由于底物中羰基的额外稳定作用,导致C-C活化较为有利。
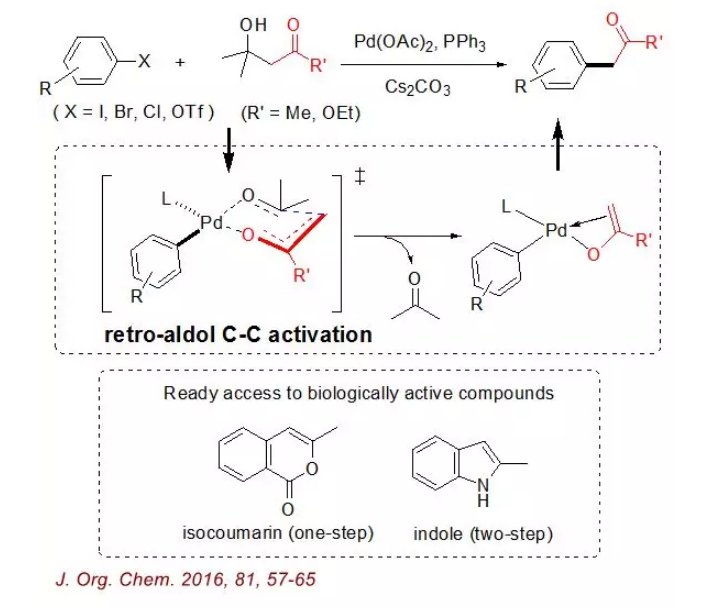 实例
实例反应利用便宜易得的Pd(OAc)2/PPh3催化体系,Cs2CO3作为硷,得到α-位单芳基化的产物,而免受传统的α-芳基化反应往往会发生多芳基化的困扰。该反应对碘、溴、氯代芳烃以及三氟甲磺酸酯都可以适用,显示了该反应重要的合成价值。利用该方法,具有生物活性的异香豆素和吲哚衍生物能简单、高效地製备出来。最后,DFT理论计算支持该反应包含一个关键的逆羟醛缩合C-C活化步生成钯烯醇盐中间体,它是整个催化循环的决速步。该逆羟醛缩合策略有望在其它基本的有机反应中得到更广泛的套用。
相关-羟醛缩合
具有α-H的醛或酮,在硷催化下生成碳负离子,然后碳负离子作为亲核试剂对醛或酮进行亲核加成,生成β-羟基醛,β-羟基醛受热脱水生成α-β不饱和醛或酮。在稀硷或稀酸的作用下,两分子的醛或酮可以互相作用,其中一个醛(或酮)分子中的α-氢加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。这个反应叫做羟醛缩合或醇醛缩合。通过醇醛缩合,可以在分子中形成新的碳碳键,并增长碳链。
羟醛缩合反应历程,以乙醛为例说明如下:
第一步,硷与乙醛中的α-氢结合,形成一个烯醇负离子或负碳离子:
第二步是这个负离子作为亲核试剂,立即进攻另一个乙醛分子中的羰基碳原子,发生加成反应后生成一个中间负离子(烷氧负离子)。
第三步,烷氧负离子与水作用得到羟醛和OH。
稀酸也能使醛生成羟醛,但反应历程不同。酸催化时,首先因质子的作用增强了碳氧双键的极化,使它变成烯醇式,随后发生加成反应得到羟醛。
生成物分子中的α-氢原子同时被羰基和β-碳上羟基所活化,因此只需稍微受热或酸的作用即发生分子内脱水而生成,α,β-不饱和醛。
凡是α-碳上有氢原子的β-羟基醛、酮都容易失去一分子水。这是因为α-氢比较活泼,并且失水后的生成物具有共轭双键,因此比较稳定。
除乙醛外,由其他醛所得到的羟醛缩合产物,都是在α-碳原子上带有支链的羟醛或烯醛。羟醛缩合反应在有机合成上有重要的用途,它可以用来增长碳链,并能产生支链。

