金属活动顺序,就是指金属的活跃程度而已,代表了金属的反应活性。至于反应的难易程度就属于套用。在金属活动顺序表中,一般位置越后的金属,金属性越弱,原子的还原性越弱;位置越前的金属,金属性越强,原子的还原性越强。
金属
Li、Cs、Rb、K、Ra、Ba、Fr、Sr、Ca、Na、Ac、La、Ce、Pr、Nd、Pm、Sm 、Eu、 Gd 、Tb 、Y 、Mg 、Am、Dy、Ho、 Er 、Tm 、Yb、 Lu 、(H)、 Sc、 Cm、Bk、Pu、Es、Lr、Fm、Cf、Th 、Np、Be、Md、U、Hf、Al、Ti 、Zr、Pa、V、No、Mn、 Nb、 Zn、Cr 、Ga 、Fe 、Cd 、In 、Tl 、Co、Ni、 Mo、 Sn 、Pb 、W、 (D2)、 (H2)、Ge、 Cu、 Tc、Ru、Po、 Hg 、Ag、Os、Rh 、Pd、Ir、Pt、Au
非金属
F、O、Cl、N、Br、I、S、C、Se、Te、At、H、P、As、B、Si
稀有气体
Xe、Kr、Ar、Ne、He
基本介绍
- 中文名:金属活动顺序
- 外文名:Metal activity order
- 性质:科学
- 类别:化学
活泼性
国中
活泼性从高到低
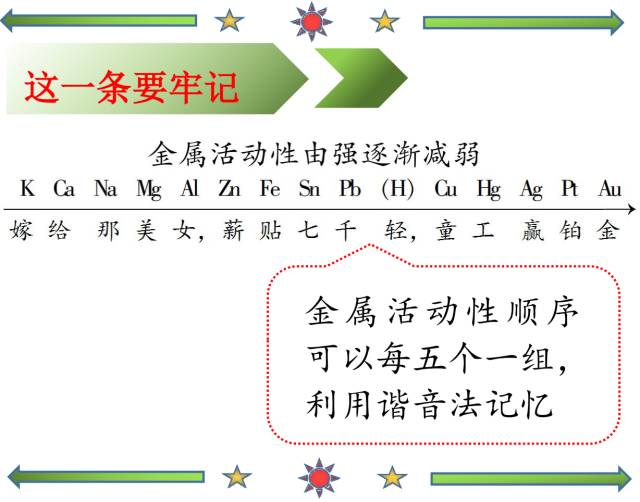
钾钙钠镁铝、锌铁锡铅(氢)、铜汞银铂金。
谐音:嫁给那美女,锌铁惜千斤,童工赢铂金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
高中
活泼性从大到小
钾钡钙钠镁铝锰、锌铬铁镍锡铅(氢)、铜汞银铂金。
K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au
综合
Li、Rb、Cs、K、Ra、Ba、Fr、Sr、Ca、Na、Ac、La、Ce、Pr、Nd、Pm、Sm 、Eu、 Gd 、Tb 、Y 、Mg 、Am、Dy、Ho、 Er 、Tm 、Yb、 Lu 、(H)、 Sc、 Cm、Bk、Pu、Es、Lr、Fm、Cf、Th 、Np、Be、Md、U、Hf、Al、Ti 、Zr、Pa、V、No、Mn、 Nb、 Zn、Cr 、Ga 、Fe 、Cd 、In 、Tl 、Co、Ni、 Mo、 Sn 、Pb 、W、(D2)、 (H2)、Ge、Cu、 Tc、Ru、Po、 Hg 、Ag、Os、Rh 、Pd、Ir、Pt、Au
锂、铷、铯、钾、镭、钡、鍅、锶、钙、钠、锕、镧、铈、鐠、钕、鉕、 钐、铕、釓、鋱、钇、镁、鎇、镝、鈥、铒、銩、镱、鑥、(氢)、钪、锔、錇、钸、鑀、鐒、镄、鐦、钍、鎿、铍、钔、铀、铪、铝、钛、锆、鏷、钒、鍩、锰、铌、锌、铬、镓、铁、镉、铟、铊、钴、镍、钼、锡、铅、钨、(氘分子)、(氢分子)、锗、铜、鎝、钋、汞、银、锇、铑、钯、铂、金
金属性关係
金属活动性最强是锂,金属性最强是铯。金属活动性是个热力学标準,由标态下的电极电势决定。
无机反应套用
判断金属与酸反应情况
(1)在氢以前的金属(K→Pb)能置换出非氧化性酸中的氢生成氢气,且从左到右由易到难,K→Na会爆炸。
(2)氢以前的金属与氧化性酸(如浓H2SO4、HNO3)反应,无氢气生成,反应的难易及产物与金属活动性、酸的浓度、温度等因素有关。
①Fe、Al在冷的浓H2SO4、浓HNO3中钝化,加热或稀HNO3可充分反应。
②Zn与HNO3反应时, HNO3浓度由浓变稀可分别生成NO2、NO、N2O、N2、NH4NO3。
③氢以后的金属(Cu→Ag)与非氧化性酸不反应,但与氧化性酸反应,与硝酸反应时,浓硝酸一般生成NO2,稀硝酸生成NO。
④氢以后的Pt→Au与氧化性酸也不反应,只能溶于王水中。
⑤在金属活动性顺序中,金属位置越靠前,它的活动性越强,置换氢气的速度就越快。
⑥实验室製取氢气时,一般不会採用K、Ca、Na,因其反应过于剧烈,甚至爆炸而无法收集。
⑦酸套用稀盐酸或稀硫酸,不能用浓硫酸和硝酸(没有氢气),一般不能用浓盐酸,因其易挥发,会影响所制的氢气的纯度。
判断金属与水反应情况
(1)K→Na,遇冷水剧烈反应,且易发生爆炸。
(2)Mg在热水中可反应,且加酚酞变红,Al在沸水中才可反应。
(3)Zn→Pb在冷水中不反应,但在加热条件下可与水蒸气反应。如:3Fe+4H2O(g )=Fe3O4+4H2
判断金属元素在自然界的存在状况
(1)K→Pb在自然界中只有化合态。(铁有游离态,陨铁)
(2)Cu→Au在自然界中既有化合态,又有游离态。 只是Pt Au大多以游离态存在
判断金属单质的冶炼方法
(1)K→Al用电解法,如:2Al2O3(熔融)==通电,催化剂==4Al+3O2↑
特例:熔融状态下 Na+KCl=NaCl+K 注:不是利用金属活动性顺序,仅是熔沸点问题!
注:Na→Mg电解氯化物,而Al电解氧化物(因为有冰晶石做催化剂)
必须熔融状态,无水!!!
(2)Zn→Cu用热还原法,常见的还原剂为:C、CO、H2或Al等。如:3CO+Fe2O3=2Fe+3CO2;2Al+Cr2O3=2Cr+Al2O3(铝热反应,冶炼难熔金属)
特例:湿法炼铜:Fe+CuSO4= FeSO4+Cu
电解精炼铜:2CuSO4+2H2O==通电==2Cu+2H2SO4+O2↑
(3)Hg→Ag用热分解法,如2HgO=2Hg+O2↑ 2Ag2O=4Ag+O2↑
(4)Pt→Au用物理方法:如用浮洗法进行沙里淘金。
判断氢氧化物的溶解性、硷性强弱
金属性越强,其对应氢氧化物的硷性越强,一般也越难溶解。
(1)K→Na对应的氢氧化物为可溶性强硷[Ca(OH)2微溶]。
(2)Mg→Cu对应的氢氧化物为难溶性弱硷[Al(OH)3、Zn(OH)2为两性氢氧化物]。
(3)Hg→Au对应的氢氧化物不存在或不稳定、易分解。
判断氢氧化物的热稳定性
金属性越强,其对应氢氧化物的热稳定性越强。
(1)K→Na对应的氢氧化物不易分解。
(2)Mg→Fe对应的氢氧化物加热可分解。如2Fe(OH)3=Fe2O3+3H2O。
(3)Sn→Cu对应的氢氧化物微热即分解。如Cu(OH)2=CuO+H2O。
(4)Hg→Ag对应的氢氧化物常温即易分解,如2AgOH = Ag2O+H2O。
(5)Pt→Au一般无对应的氢氧化物。
判断金属单质与氧气反应情况
(1)K→Na在常温下易被氧气氧化,加热时燃烧。Na在O2中燃烧生成Na2O2,K与O2可生成KO2。
(2)Mg→Fe在常温下可缓慢氧化生成一层緻密而坚固的氧化物保护膜(钝化,明显的有Zn、Al),高温时易燃烧。(Fe在常温下缓慢氧化时产生的氧化物Fe2O3是酥鬆的,并不緻密。)
(3)Sn→Pb在通常条件下,Pb可生成氧化膜,而Sn不能。高温时在氧气中燃烧。
(4)Cu→Ag在高温时与氧气化合。
(5)Pt→Au与氧气不反应,但存在氧化物,如有PtO2,Au2O3。
判断金属离子的水解情况
(1)K→Mg的金属阳离子不水解。
(2)Al→Ag的金属阳离子可水解,且水解程度逐渐增强。如Fe3++3H2O=Fe(OH)3+3H+。
判断硝酸盐热分解
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气。
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2。(硝酸亚铁出三氧化二铁!)
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
碳酸、酸式碳酸盐、碳酸盐的热稳定性
一般说,碳酸的热稳定性比碳酸氢盐小,碳酸氢盐的热稳定性比相应的碳酸盐小。不同阳离子的碳酸盐或酸式碳酸盐的热稳定性也不同。例如碳酸水溶液稍微加热就分解,碳酸氢钠在150℃左右分解,而碳酸钠加热至850℃以上才分解成氧化钠和二氧化碳。
以上各类物质的热稳定性规律可以用阳离子对碳酸根离子的反极化作用来解释。CO32-离子为一等边三角形,碳原子在中间,键角∠O—C—O为120°。在无外电场的情况下,三个氧原子被正四价的碳极化,形成偶极。当阳离子靠近某一个氧原子时,阳离子产生的外加电场使这个氧原子产生的诱导偶极方向恰好与这个氧原子原有的偶极方向相反,这个作用叫做反极化。反极化作用使这个氧原子与碳原子之间的键被削弱,甚至使CO22-离子完全分解为CO2和O2-。阳离子的极化作用越大,碳酸盐就越容易分解。
判断金属与盐溶液反应情况
(1)K→Na与盐溶液反应时,因金属活泼性太强,金属先与水反应。
(2)Mg→Zn与盐溶液反应时,其实质是金属与盐水解产生的H+反应。如Mg与AlCl3溶液反应为:Al3++3H2O=Al(OH)3+3H+,Mg+ 2H+=Mg2++ H2↑。
总反应为:3Mg+2Al3+ +6H2O=3Mg2++ 2Al(OH)3↓+3H2↑。
(3)除K→Mg外,顺序表中前面金属可将后面金属从其盐溶液中置换出来。
判断金属硫化物的溶解性
(1)K→Na的金属硫化物易溶于水。
(2)Mg→Al的金属硫化物易水解,在水中不存在。
(3)Zn→Pb的金属硫化物均不溶于水。
判断金属硫化物的颜色
(1)K→Zn的金属硫化物为无色或白色。
(2)Fe以后的金属硫化物均为黑色。